
早上(shàng),花(huā)草樹(shù)枝在露水(shuǐ)的滋潤下,顯得(de)精神煥發,散發出陣陣清香。小(xiǎo)鳥在枝
細胞治療技(jì)術(shù)已經成為(wèi)近年來(lái)最引人(rén)注目的領域之一,雖然國內(nèi)細胞治療研究不斷取得(de)重要成果,但(dàn)仍存在一些(xiē)會(huì)對細胞治療技(jì)術(shù)的臨床轉化産生(shēng)負面影(yǐng)響的不規範現象,為(wèi)此,生(shēng)物谷特别推出了系列欄目“細胞治療怎麽走?”今天為(wèi)大(dà)家(jiā)帶來(lái)《細胞治療未來(lái)展望》,供參考學習。
1. 癌症免疫細胞治療
癌症免疫療法是通(tōng)過內(nèi)源和(hé)外源方式克服免疫抑制(zhì)。美國前總統卡特在2015年12宣布其接受4個(gè)月的PD1免疫檢查點抑制(zhì)劑治療後,腦(nǎo)部的黑(hēi)素瘤已經完全消失;且自美國5歲女孩Emily接受CAR-T療法後病情得(de)到完全緩解之後,癌症免疫療法已經被列為(wèi)當年排位第一的科技(jì)進步,自此世界各大(dà)藥物和(hé)疾病研發巨頭也加強了在該領域的研究。下圖1中列出了國外參與免疫細胞治療(CAR-T、TCR-T)的部分公司

圖1. 國外參與免疫細胞治療(CAR-T、TCR-T)的部分公司
我國開(kāi)展幹細胞研究的公司比較多(duō)但(dàn)是起步較晚,而且大(dà)都屬于臨床研究階段,還(hái)有(yǒu)非常大(dà)的研究空(kōng)間(jiān)。
CAR-T療法前景:
CAR-T技(jì)術(shù)是目前研究最為(wèi)火(huǒ)熱的一種免疫細胞療法,本研究報告上(shàng)下文中也詳細介紹了CAR-T臨床研究的具體(tǐ)的情況。在目前的國內(nèi)外臨床研究進展中,美國的CAR-T臨床試驗數(shù)量穩居世界第一。來(lái)自賓夕法尼亞大(dà)學的Carl H. June 團隊在臨床上(shàng)的CAR-T研究相對較為(wèi)領先,其治療急性淋巴白血病的CD19的2期臨床結果将會(huì)在今年的7、8月份公布。美國在研項目中臨床項目仍然以CD19為(wèi)主,在實體(tǐ)瘤方面大(dà)多(duō)扔處于I期,并且已公布的臨床結果并不理(lǐ)想。例如賓夕法尼亞大(dà)學用 mRNA 暫時(shí)表達 SS1 抗 mesothelin 的臨床 1 期實驗中, 雖然觀察到了腹水(shuǐ)中癌細胞減少(shǎo), 但(dàn)是效果短(duǎn)暫, 很(hěn)快病程就進一步惡化了。 這與初期研發采用了鼠源性抗體(tǐ)并産生(shēng)了自身免疫有(yǒu)關。貝勒醫(yī)學院采用 2 代 CAR-T 以 HER2 靶點治療神經膠質瘤的 1 期臨床中, 16 個(gè)病人(rén)隻有(yǒu) 1 個(gè)達到部分緩解(Partial response,PR), 7 個(gè)病情穩定( Stable disease, SD)。 貝勒醫(yī)學院以 GD2 為(wèi)靶點治療神經膠質瘤 的早期研究中曾經有(yǒu) 3/11 的 病人(rén)達到短(duǎn)暫的完全緩解 ( Complete response, CR),但(dàn)是具有(yǒu)共刺激因子的研究結果還(hái)需要觀察。
中國的CAR-T臨床療法數(shù)量僅次于美國,但(dàn)是由于我國存在很(hěn)多(duō)技(jì)術(shù)初創公司,信息不對外公開(kāi),加上(shàng)我國細胞治療臨床實驗審批權下放在醫(yī)院一級、缺乏中心化查詢機構,還(hái)有(yǒu)技(jì)術(shù)來(lái)源不完全是醫(yī)院自主建立等原因,使得(de)我國很(hěn)多(duō)的臨床研究進展無法獲得(de)。就目前已知的CAR-T療法臨床研究情況來(lái)看,西比曼、科濟生(shēng)物、 博生(shēng)吉、 雅科生(shēng)物、 北大(dà)未名 等後發企業将目光同時(shí)瞄準了實體(tǐ)瘤和(hé)血液瘤:西比曼生(shēng)物科技(jì)收購了 301 醫(yī)院 4個(gè) CAR-T産品并擁有(yǒu)後續産品的優先權;科濟生(shēng)物獨有(yǒu)的 GPC3 靶點治療肝癌和(hé) EGFR治療神經膠質瘤; 雅科生(shēng)物在同濟醫(yī)院和(hé)陸道(dào)培血液腫瘤中心進行(xíng) CD19 産品臨床試驗;博生(shēng)吉在精囊腺癌中 MUC1靶點的 CAR-T 産品取得(de)初步療效;北大(dà)未名生(shēng)物研究所在安醫(yī)大(dà)二附院做(zuò) CD19臨床。
由于國內(nèi)相關技(jì)術(shù)企業數(shù)量的增多(duō)和(hé)國外技(jì)術(shù)的嫁接等原因,CAR-T療法在國內(nèi)的發展将會(huì)取得(de)前所未有(yǒu)的進展。而且有(yǒu)可(kě)能會(huì)在某些(xiē)地方趕超歐美國家(jiā)。但(dàn)是由于國內(nèi)政策的缺失,當前實驗規範程度不夠,所以預期在海外獲批之後,國內(nèi)才會(huì)跟進。
基因編輯輔助細胞治療
基因編輯技(jì)術(shù)指特異性剪切基因組DNA位點的技(jì)術(shù)。基因編輯特指在基因組上(shàng)進行(xíng)特定位點的剪切。基因編輯是指在基因組上(shàng)剪切将基因編輯與傳統的暫時(shí)性表達的質粒區(qū)分開(kāi)來(lái),對特定位點剪切将基因編輯與随機整合進入基因組的逆轉錄病毒區(qū)分開(kāi)來(lái)。下圖2描述了基因編輯的步驟和(hé)預期達到的效果
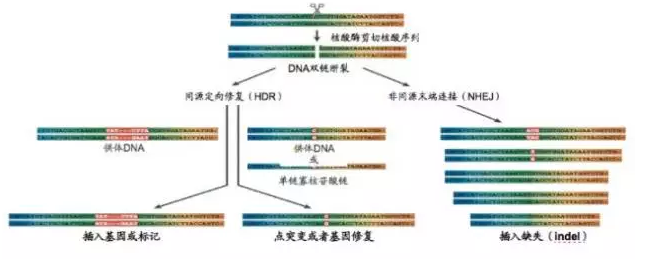
圖2. 基因編輯的步驟和(hé)預期達到的效果
基因編輯的優勢在于特異性直接編輯基因組,具有(yǒu)可(kě)持續性和(hé)安全性。當前的基因編輯技(jì)術(shù)主要分為(wèi)三種:ZFN、TALEN和(hé)CRISPR,它們的技(jì)術(shù)各具優勢,這三種技(jì)術(shù)的比較圖如下圖3:
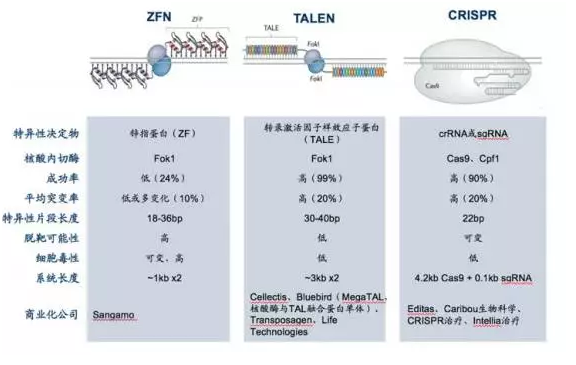
圖3. ZFN、TALEN和(hé)CRISPR技(jì)術(shù)比較
基因編輯在臨床應用上(shàng)仍然處于早期,主要應用仍然在科研領域。傳統上(shàng)基因編輯技(jì)術(shù)主要用于缺失某種正常蛋白的的罕見病領域,例如Bluebird Bio在鐮刀血病中就是利用 MegaTAL 實現基因編輯。在過繼免疫細胞治療領域,CAR-T 與 TCR-T公司( 例如Cellectis、 Adaptimmune)等都采用基因編輯敲除內(nèi)在TCR 和(hé)MHC的方法制(zhì)作(zuò)通(tōng)用細胞,另外敲除 CD52 也可(kě)以獲得(de)對化療藥物的耐藥性。總的來(lái)說,雖然前景廣大(dà),但(dàn)是技(jì)術(shù)本身還(hái)處于臨床研究期,離大(dà)面積進入應用還(hái)有(yǒu)段距離。另一方面在科研領域,CRISPR對于研制(zhì)基因敲除動物模型有(yǒu)重大(dà)幫助。由于采用廉價的核酸識别,而不是費時(shí)費力的設計(jì)結合蛋白,極大(dà)的降低(dī)了模式動物創制(zhì)的成本。
TCR
T細胞受體(tǐ)(TCR)修飾的T細胞是當前過繼性細胞治療ACT技(jì)術(shù)中兩大(dà)最新的技(jì)術(shù)之一(另一項是CAR-T),實現了從基礎免疫學機制(zhì)研究到臨床免疫治療應用的轉變。目前有(yǒu)三種使用效應T細胞的過繼細胞療法正朝着注冊審批的方向行(xíng)進(圖4)。腫瘤浸潤性淋巴細胞(TILs)雖發展緩慢,但(dàn)數(shù)十年來(lái)一直進步,近期一項針對轉移性黑(hēi)色素瘤的國際III期随機試驗已經開(kāi)始。新近組建的Lion Biotechnologies公司正商業化應用TILs治療黑(hēi)色素瘤和(hé)其他有(yǒu)T細胞浸潤的腫瘤。
與TILs相比,開(kāi)發轉基因的方法克服對腫瘤特異性T細胞免疫耐受。這種方法通(tōng)過轉導嵌合抗原受體(tǐ)(融合抗原結合域及T細胞信号結構域)或者TCR α/β異二聚體(tǐ),使T細胞能夠重新高(gāo)效的識别靶細胞。通(tōng)過輸注能夠識别特異靶标的基因修飾T細胞,賦予免疫系統以新的非自然免疫活性。這種方法除了能像細胞毒性化療和(hé)靶向治療快速殺滅腫瘤外,還(hái)避免了疫苗和(hé)T細胞檢查點療法的延遲效應。
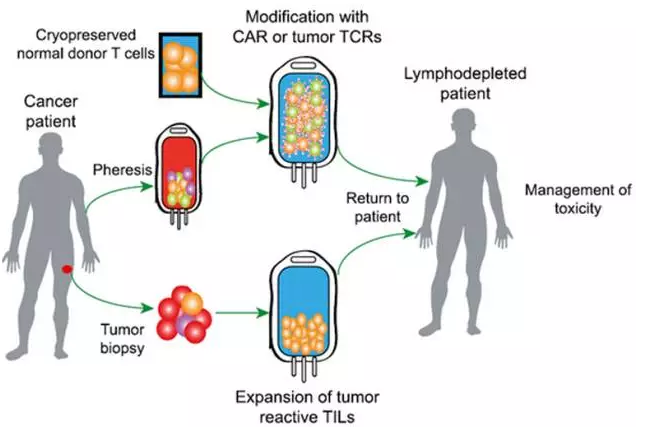
圖4:目前細胞治療的幾種途徑。通(tōng)過修飾,使正常供體(tǐ)細胞的同種異體(tǐ)排異反應失活,同時(shí)使用抗腫瘤的CAR或TCR武裝它;或利用抗腫瘤分子武裝患者自體(tǐ)細胞。在實體(tǐ)腫瘤中,活檢标本可(kě)用來(lái)分離TILs并進行(xíng)擴增。大(dà)多(duō)數(shù)情況下,病人(rén)在接受抗腫瘤淋巴細胞輸注前需要接受必要的預處理(lǐ),并須謹慎處置治療引發的毒性。
除了極個(gè)别情況外,細胞療法的個(gè)性化指的是自體(tǐ)的、源于患者的T細胞。正因如此,過繼細胞治療的開(kāi)發主要依賴于學術(shù)界與制(zhì)藥行(xíng)業的緊密合作(zuò)。在這個(gè)模式中,學術(shù)界與工業界共存,前者開(kāi)發和(hé)檢驗細胞工程技(jì)術(shù)的新思路,後者擴大(dà)和(hé)實現新方法在醫(yī)療健康領域中的影(yǐng)響力。這種學界和(hé)工業界的合作(zuò)夥伴關系已經在全球的許多(duō)機構中出現,包括賓夕法尼亞大(dà)學與諾華,貝勒醫(yī)學院與Bluebird Bio、Celgene公司,紀念斯隆-凱特林癌症中心、哈欽森(sēn)弗萊德癌症研究中心與Juno Therapeutics公司,國立癌症研究所與Kite Pharma,西比曼與中國解放軍總醫(yī)院。總體(tǐ)來(lái)說,現在有(yǒu)數(shù)十家(jiā)細胞治療領域的企業總投資達數(shù)十億美元。
這種合作(zuò)關系的影(yǐng)響力仍不明(míng)确,學術(shù)界的學術(shù)自由與大(dà)型企業專注于價值相遇必将産生(shēng)沖突,尋求校(xiào)外的項目資金支持和(hé)知識産權的歸屬問題,将成為(wèi)創造這個(gè)領域的學者與謀求獲得(de)技(jì)術(shù)授權的制(zhì)藥公司之間(jiān)激烈争論的話(huà)題。
2. 幹細胞療法
機理(lǐ)研究與突破
在人(rén)體(tǐ)的發生(shēng)發育過程中,胚胎和(hé)成年組織中可(kě)能存在着具有(yǒu)多(duō)向分化潛能的幹細胞。胚胎幹細胞來(lái)源于人(rén)或動物胚胎內(nèi)的細胞團或原始生(shēng)殖嵴的一種多(duō)能細胞。胚胎幹細胞幾乎可(kě)以向所有(yǒu)的成年組織分化。
目前國內(nèi)外近年來(lái)有(yǒu)關的幹細胞治療主要有(yǒu)幾種疾病的臨床研究報道(dào)情況如下:
1).MSCs治療脊髓損傷
通(tōng)過搜索國內(nèi)外相關的臨床文獻可(kě)知,接受脊髓損傷的患者的實驗指标(ASIA觸覺評分、Frankel評分總體(tǐ)改善率、日常生(shēng)活能力訓練評分)具有(yǒu)更高(gāo)的低(dī)熱反應,與對照組相比差異有(yǒu)顯著性意義(P<0.05),說明(míng)間(jiān)充質幹細胞移植治療骨髓損傷有(yǒu)一定的療效并未發生(shēng)嚴重并發症,但(dàn)是還(hái)需要高(gāo)質量的随機對照研究來(lái)證實間(jiān)充質幹細胞的安全性及有(yǒu)效性。
2). 治療重症系統性紅斑狼瘡(SLE)
南京大(dà)學附屬鼓樓醫(yī)院在2009年通(tōng)過治療結果首次證明(míng)了異體(tǐ)MSCs治療SLE安全有(yǒu)效。且病人(rén)在移植MSCs後9個(gè)月及12個(gè)月時(shí)有(yǒu)一定的複發率,提示可(kě)在移植後6個(gè)月給予重複輸注以維持疾病的長期緩解。
3). 幹細胞治療急性植物抗宿主疾病
檢索有(yǒu)關MSCs預防HSCT後GVHD方面的臨床文獻,通(tōng)過研究文獻試驗結果可(kě)知:MSCs未能降低(dī)急、慢性GVHD發生(shēng)率;MSCs未參加原發病複發率及巨細胞病毒感染率;MSCs未改善病人(rén)總體(tǐ)生(shēng)存率。MSCs可(kě)能對GVHD有(yǒu)一定的預防作(zuò)用,但(dàn)由于尚缺乏大(dà)樣本的RCT證據支持,MSCs對GVHD的預防作(zuò)用尚不能作(zuò)出最後結論。
4). 幹細胞治療心肌梗死和(hé)缺血性心力衰竭
海軍總醫(yī)院與國內(nèi)11所醫(yī)院及北科生(shēng)物合作(zuò)研究,進行(xíng)了國內(nèi)首個(gè)随機、雙盲、安慰劑對照的 WJ-MSCs經冠狀動脈移植治療急性心肌梗死的臨床試驗,結果表明(míng),WJ-MSCs治療急性心肌梗死是安全的,無免疫反應,可(kě)明(míng)顯縮小(xiǎo)心肌梗死範圍,顯著提高(gāo)心髒收縮功能,有(yǒu)效預防心肌梗死後心髒重構及心力衰竭發生(shēng),且另有(yǒu)證據表明(míng),原始的 WJ-MSCs 确實遠較自體(tǐ)的成體(tǐ)幹細胞更具旁/自分泌效應,更具增殖活力及分化潛能。另有(yǒu)試驗表明(míng),幹細胞治療缺血性心力衰竭與急性心肌梗死對于減小(xiǎo)患者梗死面積、提高(gāo)左心室射血功能具備着确切的安全性以及治療效果。
5). 幹細胞治療中樞神經系統疾病
霍普金斯大(dà)學的研究人(rén)員 Karussis等人(rén)的對于幹細胞的臨床研究結果表明(míng)幹細胞具有(yǒu)定向遷移的能錄且較為(wèi)安全,還(hái)發現骨髓間(jiān)充質幹細胞具有(yǒu)顯著的免疫調控功能。
劍橋大(dà)學間(jiān)充質幹細胞在該領域的研究實驗結果表明(míng)間(jiān)充質幹細胞治療前後沒有(yǒu)觀察到嚴重的不良事件,而且經間(jiān)充質幹細胞治療後患者的視(shì)力以及視(shì)覺誘發反應均有(yǒu)所改善,而且視(shì)神經區(qū)域增加。
日本劄幌醫(yī)科大(dà)學的研究人(rén)員進行(xíng)的間(jiān)充質幹細胞相關研究證明(míng)了間(jiān)充質幹細胞可(kě)以有(yǒu)效減少(shǎo)腦(nǎo)卒病竈;韓國亞洲大(dà)學的間(jiān)充質幹細胞臨床研究結果表明(míng)間(jiān)充質幹細胞在缺血性中風治療中安全有(yǒu)效。
6). 幹細胞治療肝功能衰竭
通(tōng)過查找相關臨床實驗資料可(kě)知,自體(tǐ)外周血幹細胞治療可(kě)以成為(wèi)肝移植前的過渡治療手段。
7). 幹細胞治療糖尿病足
日本Kansai醫(yī)科大(dà)學的醫(yī)生(shēng)和(hé)我國的科研人(rén)員對糖尿病足病患者的臨床治療,結果發現該治療手段使大(dà)多(duō)數(shù)患者達到了避免截肢或降低(dī)截肢平面的目的。目前我國采用自體(tǐ)骨髓幹細胞移植治療下肢缺血的例數(shù)大(dà)約在8000例左右,從目前臨床上(shàng)反饋的結果證明(míng)了這是一種非常安全的有(yǒu)效、值得(de)推廣的技(jì)術(shù)。
8). 幹細胞治療黃斑變性
在美國加利福利亞大(dà)學Stein眼科學院、 Wills眼科醫(yī)院、 Bascorn Palmer眼科學院展開(kāi)的hESC-RPE細胞懸液移植多(duō)中心I/ II期臨床試驗中, 采用 ACT公司提供的hESC-RPE對幹性AMD和(hé)Stargardt病患者進行(xíng)視(shì)網膜下腔注射。實驗結果發現患者的症狀得(de)到了有(yǒu)效緩解。
幹細胞研究進展:
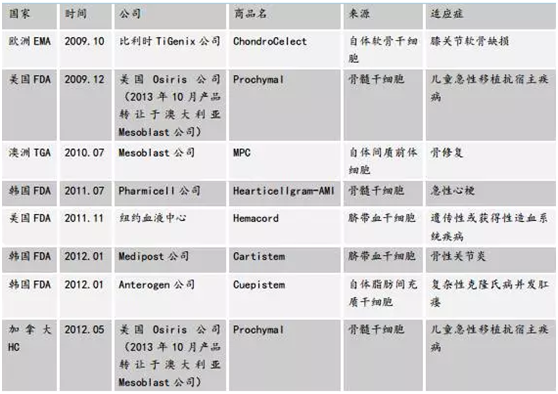
随着國際上(shàng)多(duō)個(gè)發達國家(jiā)和(hé)地區(qū)幹細胞應用相關法規的頒布,幹細胞産品的研發和(hé)在于疾病的應用研發也有(yǒu)了較好的成果和(hé)較大(dà)的突破。韓國在幹細胞藥物領域的研發為(wèi)世界矚目,下表1列出了近年來(lái)研制(zhì)出的幹細胞産品
表1. 近年來(lái)研制(zhì)出的幹細胞産品
|
産品 |
批準單位 |
公司 |
時(shí)間(jiān) |
适應症 |
|
Hearticellgram-AMI |
韓國FDA |
FCB-Pharmicell |
2011 |
急性心肌梗死 |
|
Cuepistem |
韓國FDA |
IPAnterogen |
2012 |
肛瘘 |
|
Caristem |
韓國FDA |
Medipost |
2012 |
軟骨損傷和(hé)退行(xíng)性關節炎 |
|
ChondroCelect |
歐盟EMA |
ChondroCelect |
2009 |
自體(tǐ)軟骨幹細胞 |
|
MPC |
澳大(dà)利亞TGA |
Mesoblast |
2010 |
膝關節軟骨缺損 |
|
HEMACORD |
美國FDA |
紐約血液中心 |
2011 |
遺傳性或獲得(de)性造血系統疾病 |
|
DuCord |
美國FDA |
DUKE大(dà)學 |
2012 |
臍帶血造血 |
|
HPC |
美國FDA |
Clinimmune實驗室 |
2012 |
臍帶血造血 |
|
Prochymal |
加拿(ná)大(dà)藥監局 |
OsirsTherapeutics |
2012 |
小(xiǎo)兒移植物抗宿主病(CVHD) |
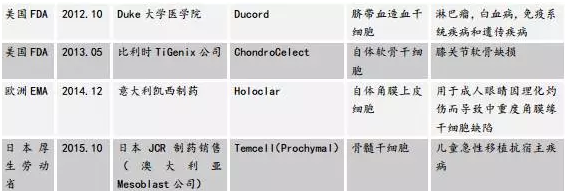
目前國內(nèi)外已獲批的幹細胞産品如表2:
表2. 國內(nèi)外已獲批的幹細胞産品
幹細胞治療産品安全性:
目前,幹細胞的研究正在向臨床應用轉化,幹細胞的安全性數(shù)據多(duō)來(lái)自一些(xiē)幹細胞的早期探索研究和(hé) I、 II 期臨床試驗。總體(tǐ)來(lái)看,胚胎幹細胞已經在動物試驗中發現,未經分化的胚胎幹細胞移植後可(kě)以形成畸胎瘤;誘導多(duō)能幹細胞已經被證明(míng)大(dà)約 20% 誘導多(duō)能幹細胞後代會(huì)發生(shēng)腫瘤,且其誘導過程中需使用反轉錄病毒,對臨床使用的安全性也需要驗證。應用于臨床治療的細胞資源需要同時(shí)符合幾個(gè)重要條件,即培養方便、可(kě)以在體(tǐ)外大(dà)量增殖,獲得(de)的終末分化細胞需要具有(yǒu)功能,同時(shí)又具備較低(dī)的緻瘤風險。然而到目前為(wèi)止,無論是具備亞全能性的胚胎幹細胞還(hái)是體(tǐ)細胞來(lái)源的誘導型多(duō)能性幹細胞,直接進行(xíng)體(tǐ)外分化,都無法同時(shí)滿足這些(xiē)要求;異體(tǐ)造血幹細胞最嚴重的不良反應是急慢性的移植物抗宿主病,會(huì)影(yǐng)響移植成功的患者的存活。間(jiān)充質幹細胞目前的臨床研究上(shàng)沒有(yǒu)發現嚴重的不良反應;脂肪幹細胞研究也未發現與移植有(yǒu)關的嚴重不良反應。從目前的研究結果和(hé)文獻來(lái)看,自體(tǐ)造血幹細胞、間(jiān)充質幹細胞、神經幹細胞、脂肪幹細胞等成體(tǐ)幹細胞移植,相對來(lái)說比較安全。
如需了解更多(duō)資訊,敬請(qǐng)關注東銳科技(jì)公衆号
