基于業務架構支撐平台開(kāi)發的制(zhì)藥質量控制(zhì)系統(FE LIMS),已經廣泛推廣于衆多(duō)制(zhì)藥企業,在企業實驗室應用中建立完善的質量保證體(tǐ)系,實習檢驗數(shù)據網絡化共享、無紙化記錄與辦公、資源與成本管理(lǐ)、人(rén)員量化考核,為(wèi)實驗室管理(lǐ)水(shuǐ)平的整體(tǐ)提高(gāo)和(hé)實驗室的全面管理(lǐ)提高(gāo)先進的技(jì)術(shù)支持。
一、特點:
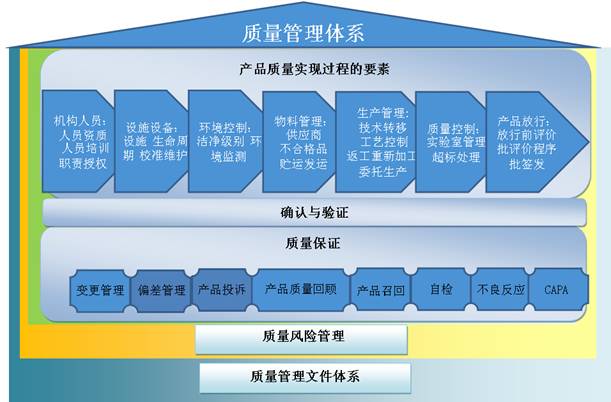
n 檢驗環節分析,樣品全生(shēng)命周期監控
在樣品分析周期中,對各個(gè)環節(如請(qǐng)檢、取樣、領養、結果錄入、核對、審核、出報告、放行(xíng)等)處理(lǐ)時(shí)間(jiān)進行(xíng)統計(jì)分析,以便管理(lǐ)人(rén)員及時(shí)地了解檢測的進展情況及滞留的節點,督促相人(rén)員及時(shí)進行(xíng)相關操作(zuò),以使檢測按時(shí)完成。
n 自動化儀器(qì)數(shù)據的自動采集
采用“與設備無關”的軟硬件接口技(jì)術(shù),将不同接口類型的自動化儀器(qì)與LIMS進行(xíng)連接。隻要儀器(qì)具備數(shù)據輸出功能,不管是采用何種方式,都能實現數(shù)據的快速自動采集。
n 批記錄跟蹤
為(wèi)遵守規則規範,在确保系統擁有(yǒu)豐富而強大(dà)的功能的同時(shí),在系統核心提供了內(nèi)置的審核
跟蹤功能。這些(xiē)增強性的工具包括一個(gè)集成的電(diàn)子記錄管理(lǐ)模塊,該模塊存儲了一個(gè)具體(tǐ)分析測試中所涉及的所有(yǒu)實驗室資源的完整審核記錄(包括分析人(rén)員、儀器(qì), 标準物質以及SOP),這樣也可(kě)确保實驗室滿足FDA 等各種質量規範的要求
n 建立科學、持續的穩定性考察,确保産品質量
系統提供重點留樣和(hé)穩定性考察兩種解決方案。留樣品種隻需要做(zuò)一次安排就能自動請(qǐng)檢,用戶無需每天都去看留樣台賬,減輕留樣人(rén)員的工作(zuò)量,還(hái)有(yǒu)自動生(shēng)成留樣台賬,方便對産品質量進行(xíng)跟蹤和(hé)統計(jì)分析;穩定性考察除了有(yǒu)留樣功能外,還(hái)提高(gāo)了穩定性方案、中期報告和(hé)最終報告審批流程,以及到期預警功能。
n 全方位環境檢測,透析質量趨勢
提供決策數(shù)據。對生(shēng)産車(chē)間(jiān)或微生(shēng)物室的環境進行(xíng)檢測,可(kě)以按不同檢測項目,以及級别進行(xíng)環境檢測,根據它的标準出準确檢測數(shù)據,通(tōng)過數(shù)據統計(jì)分析,得(de)出環境質量情況,為(wèi)質量管理(lǐ)人(rén)員
n 健全嚴重管理(lǐ)規範,杜絕質量隐患
從國內(nèi)企業GMP認證情況來(lái)看,驗證也是GMP實施過程中最薄弱的環節,由于沒有(yǒu)對生(shēng)産工藝、廠房(fáng)設施、設備等進行(xíng)嚴格的驗證,生(shēng)産過程存在着很(hěn)多(duō)質量隐患。系統提供簡單、靈活的流程化審批方式,可(kě)及時(shí)跟蹤和(hé)追溯驗證全過程。
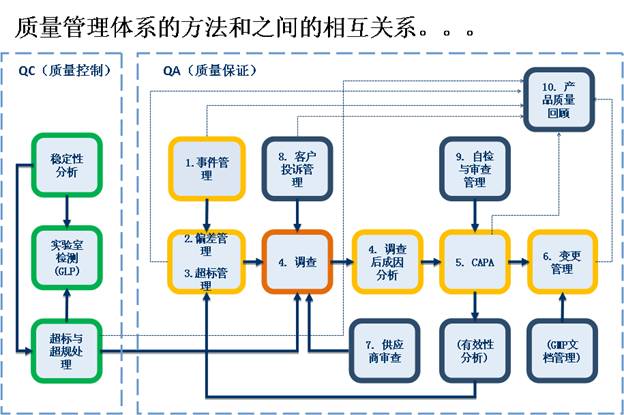
n 引進風險評估機制(zhì),完善變更、偏差、審計(jì)等質量過程
根據最新版GMP要求,FE LIMS引進風險評估管理(lǐ)體(tǐ)系,大(dà)大(dà)完善了質量變更、偏差等過程,給生(shēng)産過程提供有(yǒu)力的質量保障。用戶操作(zuò)偏差、變更等流程時(shí)啓動風險評估流程,在風險評估流程走完時(shí),系統會(huì)自動把結果回寫給偏差、變更等流程,完成整個(gè)質量過程。
n 過程文件管理(lǐ),實時(shí)記錄、追蹤、監控
系統提供整套完善質量文件管理(lǐ)系統,供企業去選擇自己适用的文件管理(lǐ),保證事事有(yǒu)依據、事事有(yǒu)記錄、事事可(kě)追蹤、事事可(kě)監控,防止差錯、防止混淆、防止污染和(hé)交叉污染,确保質量安全,有(yǒu)效、質量可(kě)控。
n 持證上(shàng)崗,嚴格培訓管理(lǐ)
制(zhì)藥企業人(rén)員必須培訓GMP才可(kě)上(shàng)崗,企業所有(yǒu)員工都必須按照本崗的培訓要求接受培訓,隻有(yǒu)培訓合格方可(kě)上(shàng)崗。許多(duō)藥害事件都是培訓不足引起的,這是保證藥品生(shēng)産質量的重要手段。FE LIMS針對企業生(shēng)産、檢驗管理(lǐ)建立健全培訓體(tǐ)系,包括人(rén)員檔案、培訓計(jì)劃、培訓記錄、培訓考核、培訓檔案等功能,系統任何功能都需要經過培訓合格方可(kě)進行(xíng)操作(zuò),嚴格遵守GMP要求,确保藥品生(shēng)産的質量安全。
n 嚴格的供應商控制(zhì),快速溯源
系統對新增或變更的供應商進行(xíng)嚴格的資質調查、審計(jì)、評估、小(xiǎo)試等控制(zhì),對供應商提供的物料進行(xíng)分析和(hé)跟蹤,包括供應商檢驗批次、合格批次、不合格批次、合格率等,并細分到供應商提供的每種物料,對不同物料的注冊證進行(xíng)監控。對供應商資質有(yǒu)效期進行(xíng)實時(shí)監控,提前預警,讓相關質量負責人(rén)快速作(zuò)出決策。
n 實時(shí)準确的預警平台,做(zuò)到未雨綢缪
系統提供一個(gè)預警平台.企業可(kě)以針對自己的需要進行(xíng)設置,現已提供以下預警指标:一是對重點品種的中間(jiān)産品、成品等關鍵指标設定預警線,登錄結果的同時(shí)就能判定品種是否超出預警線,二是留樣和(hé)穩定性考察自動提醒相關人(rén)員,并自動生(shēng)成請(qǐng)檢單;三是不合格成品自動預警提醒;四是供應商資質過期預警;五是試劑和(hé)物料庫存量預警;六是文件有(yǒu)效期自動預警,七是其他自定義預警設置,系統能自動通(tōng)知相關質質量管理(lǐ)人(rén)員,質量負責人(rén)就能及時(shí)作(zuò)出決策;對産品質量進行(xíng)分析處理(lǐ),以免失去且最佳處理(lǐ)時(shí)機。
n 智能分析報表、輔助領導決策
在數(shù)據積累的基礎上(shàng),實施智能圖形報表分析系統。晚上(shàng)決策分析系統;實施預警分析、領導質量監督駕駛艙,對業務數(shù)據進行(xíng)深層分析,為(wèi)決策服務。
n 無縫的系統集成,整合企業資源
系統具備良好的擴展和(hé)整合能力,即支持與ERP、HR、财務、CRM、MES等系統進行(xíng)整合,從而優化企業資源,降低(dī)企業生(shēng)産、辦公成本。
n 移動辦公,信息全局“掌”控
系統支持手機短(duǎn)信平台,支持智能終端(手機)的移動應用;支持采用安裝手機客戶端或WAP的方式,支持在手機上(shàng)查看WORD、EXCEL等多(duō)種附件,兼容android、iphoneOS、window mobile等主流操作(zuò)系統;領導在手機上(shàng)就能查看産品不合格情況、物料不合格情況、生(shēng)産質量過程情況、産品穩定性情況、檢驗費用彙總表等統計(jì)報表。
二、
應用價值:
系統嚴格遵循IS0 9000、IS0/IEC 17025、G(A)LP、GMP、FDA等标準規範,幫助企業建立完整的質量保證和(hé)質量控制(zhì)體(tǐ)系,降低(dī)企業經營成本,完善質量風險控制(zhì),從而使企業快速健康發展起來(lái)。
n 規範---建立質量管理(lǐ)體(tǐ)系
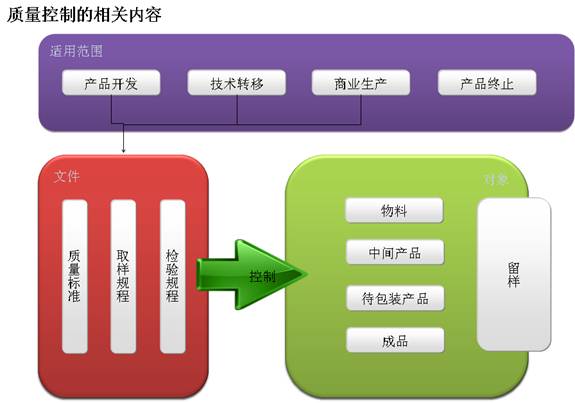
系統提供全生(shēng)命周期管理(lǐ)的質量管理(lǐ)模塊,涵蓋了供應商管理(lǐ)、變更管理(lǐ)、偏差管理(lǐ)、驗證管理(lǐ)、審計(jì)管理(lǐ)、風險評估管理(lǐ)、放行(xíng)管理(lǐ)、投訴管理(lǐ),不良反應管理(lǐ)、質量目标管理(lǐ)等 QA 管理(lǐ),還(hái)包括檢驗管理(lǐ)、留樣管理(lǐ)、穩定性管理(lǐ)、人(rén)員管理(lǐ)、儀器(qì)管理(lǐ)等QC管理(lǐ),為(wèi)企業質量發展日過安全的保障。将各級管理(lǐ)人(rén)員從日常的 GMP 檢查中解放出來(lái),利用更多(duō)時(shí)間(jiān)做(zuò)好本職的工作(zuò)。
n 可(kě)控---實現統一質量監管平台
從原材料采購、倉儲檢驗、生(shēng)産過程控制(zhì)、成品檢驗、放行(xíng)、投訴跟蹤、召回等相關質量過程進行(xíng)全程監控,質量受權人(rén)通(tōng)過系統就能實時(shí)掌控一切質量情況,杜絕一切不規範的質量操作(zuò)過程,在最短(duǎn)時(shí)間(jiān)內(nèi)作(zuò)出相應措施,把質量風險最小(xiǎo)化.。在整個(gè)産品生(shēng)命周期中采用前瞻或回顧的方式,對質量風險進行(xíng)評估、控制(zhì)、溝通(tōng)、審核的管理(lǐ)過程.通(tōng)過對偏差、變更、驗證、投訴、供應商審計(jì)等環節進行(xíng)質量風險評估,将風險最小(xiǎo)化,實現風險可(kě)控,确保産品質量.
n 減耗---為(wèi)企業節約成本
系統所提供的規範管理(lǐ)程序,減少(shǎo)和(hé)避免做(zuò)樣的反複,從而減少(shǎo)對照品、試劑、培養基平闆等實驗用品的消耗;對重點物料進行(xíng)嚴密控制(zhì),杜絕浪費;對實驗動物進行(xíng)統一管理(lǐ),重複利用,有(yǒu)的放矢,建立統一質量辦公平台,實現辦公無紙化,減少(shǎo)紙張浪費;對儀器(qì)使用進行(xíng)統計(jì)分析,提供儀器(qì)的利用率;對人(rén)員進行(xíng)量化考核,優化人(rén)力資源的分配,減少(shǎo)人(rén)工成本;整台企業內(nèi)部協同辦公平台,降低(dī)企業運營成本。
n 整合---資源整合、提高(gāo)工作(zuò)效率
系統整合了協同辦公功能,使質檢部門(mén)和(hé)其他部門(mén)更加緊密結合起來(lái),形成一個(gè)統一質檢業務協作(zuò)平台。除了整個(gè)企業內(nèi)部資源外,還(hái)具備良好的擴展和(hé)整合外部系統能力,即支持與 ERP、MES、OA 、HR 、CRM 等系統進行(xíng)整合,從而優化企業資源,減少(shǎo)手工錄入的錯誤,加快數(shù)據傳送的速度;統一的樣品登記和(hé)調度系統,減少(shǎo)樣品的周轉時(shí)間(jiān),提高(gāo)做(zuò)樣量,同時(shí)杜絕重複做(zuò)樣;通(tōng)過對數(shù)據的統計(jì)與趨勢分析,可(kě)以追蹤産品的性能、标準、方法等情況,警告不良的質量變化趨勢,防止不合格産品的産生(shēng),從而達到質量管理(lǐ)全過程的高(gāo)效工作(zuò)。
三.産品優勢:
n 權威
經過衆多(duō)家(jiā)制(zhì)藥企業成功推行(xíng)與實施,在業界得(de)到良好評論,并得(de)到省藥監局相關部門(mén)的贊許和(hé)認可(kě),2011年10月,榮獲省藥監局旗下權威雜志(zhì)《China AP 藥品質量受權人(rén)》指定唯一重點推薦産品
n 标準
1、系統嚴格遵循ISO 9000、ISO/IEC 17025、GMP、FDA等标準規範
2、緊跟國家(jiā)藥品制(zhì)度頒布,及時(shí)完善産品功能
n 本地化服務
1、指派當地辦事處和(hé)本地用友(yǒu)夥伴,提供專業、完善、及時(shí)的本地化服務 。
2、提供永久的軟件系統升級和(hé)擴充服務
n 專業
擁有(yǒu)一支深入制(zhì)藥行(xíng)業、具有(yǒu)專業、全面的制(zhì)藥行(xíng)業信息化建設背景、及LIMS系統建設的研發隊伍(近100餘人(rén)),從事于制(zhì)藥行(xíng)業信息化相關系統的開(kāi)發及實施服務工作(zuò),對業務及審批流程有(yǒu)着充分的了解,為(wèi)後期持續的技(jì)術(shù)支持工作(zuò)打下堅實的基礎 。
n 集成
1、與ERP、MES、OA、HR、CRM等系統進行(xíng)集成,優化企業資源,目前與ORACLE,UFIDA,SAP等廠商集成。
2、它既可(kě)以整合企業內(nèi)部系統,也可(kě)以開(kāi)放給不同廠商和(hé)客戶。
n 平台
擁有(yǒu)運用成熟的業務開(kāi)發平台,能基于應用框架快速搭建客戶的個(gè)性化業務系統。本方案是采用基于飛企FE業務基礎平台而設計(jì)的。FE是一個(gè)強大(dà)的支撐平台,包括業務流程配置平台、審批流配置平台、參數(shù)配置平台、預警平台、各種模闆等,平台思想的實施應用,能适應業務變化和(hé)市場(chǎng)競争,滿足可(kě)持續發展要求奠定了良好基礎。