
早上(shàng),花(huā)草樹(shù)枝在露水(shuǐ)的滋潤下,顯得(de)精神煥發,散發出陣陣清香。小(xiǎo)鳥在枝
轉染——是指将外源基因如DNA、RNA等導入真核細胞的技(jì)術(shù)。随着分子生(shēng)物學和(hé)細胞生(shēng)物學研究的不斷發展,轉染已經成為(wèi)研究和(hé)控制(zhì)真核細胞基因功能的常規工具。在研究基因功能、調控基因表達、突變分析和(hé)蛋白質生(shēng)産等生(shēng)物學實驗中,其應用越來(lái)越廣泛。
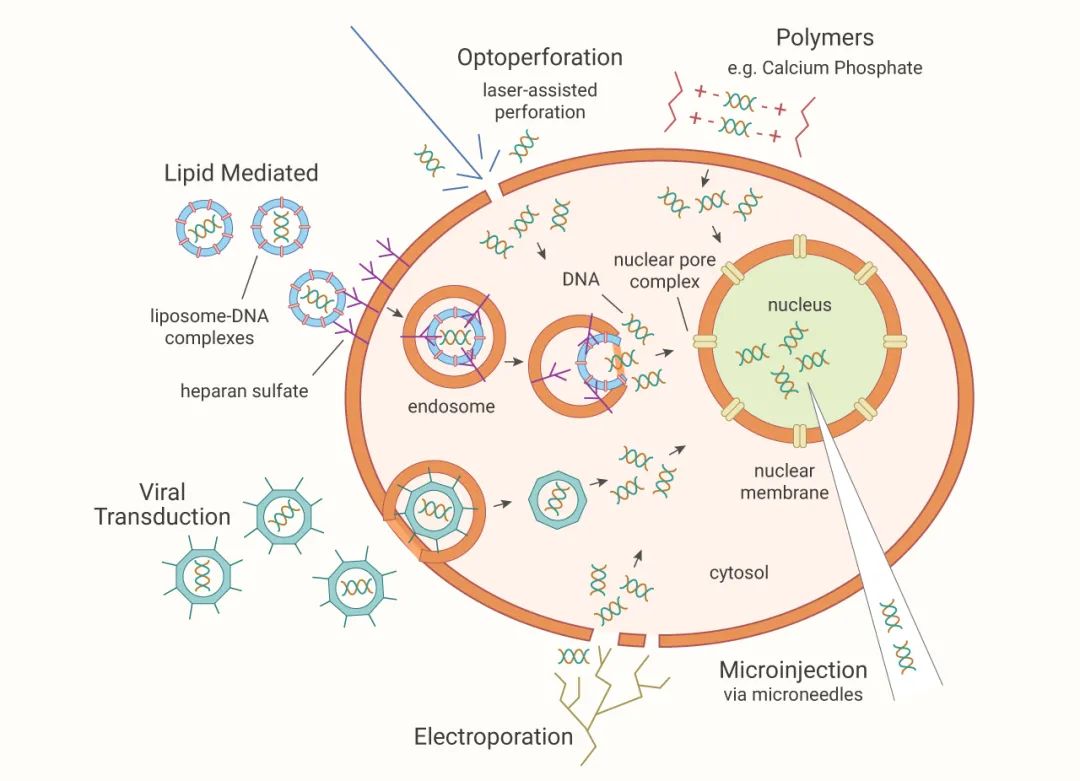
圖 | 常見轉染技(jì)術(shù)原理(lǐ)
細胞轉染技(jì)術(shù)主要分為(wèi)三大(dà)類:物理(lǐ)介導法、化學介導法及生(shēng)物介導法:
一般是電(diàn)穿孔法,适用于極難轉染的細胞,如原代細胞,轉染效率高(gāo),但(dàn)轉染後細胞死亡率也很(hěn)高(gāo)。
選用轉染試劑與核酸結合,通(tōng)過內(nèi)吞作(zuò)用進入細胞。一般轉染試劑有(yǒu)以下三種:
磷酸鈣:成本低(dī),但(dàn)轉染效率低(dī),重複性差;
陽離子脂質體(tǐ):轉染效率較高(gāo),但(dàn)脂質體(tǐ)可(kě)能改變細胞的結構,對細胞毒性較大(dà);
非脂質體(tǐ)試劑:以脂類為(wèi)主的多(duō)組分試劑,轉染效率高(gāo),對細胞毒性低(dī),且可(kě)生(shēng)物降解。
病毒載體(tǐ),轉染效率高(gāo),但(dàn)整合到基因組的風險大(dà),基因長度也受限,比較适合構建穩轉的細胞株。
所以,綜合考慮到高(gāo)轉染效率和(hé)低(dī)細胞毒性的結合,請(qǐng)看下圖:
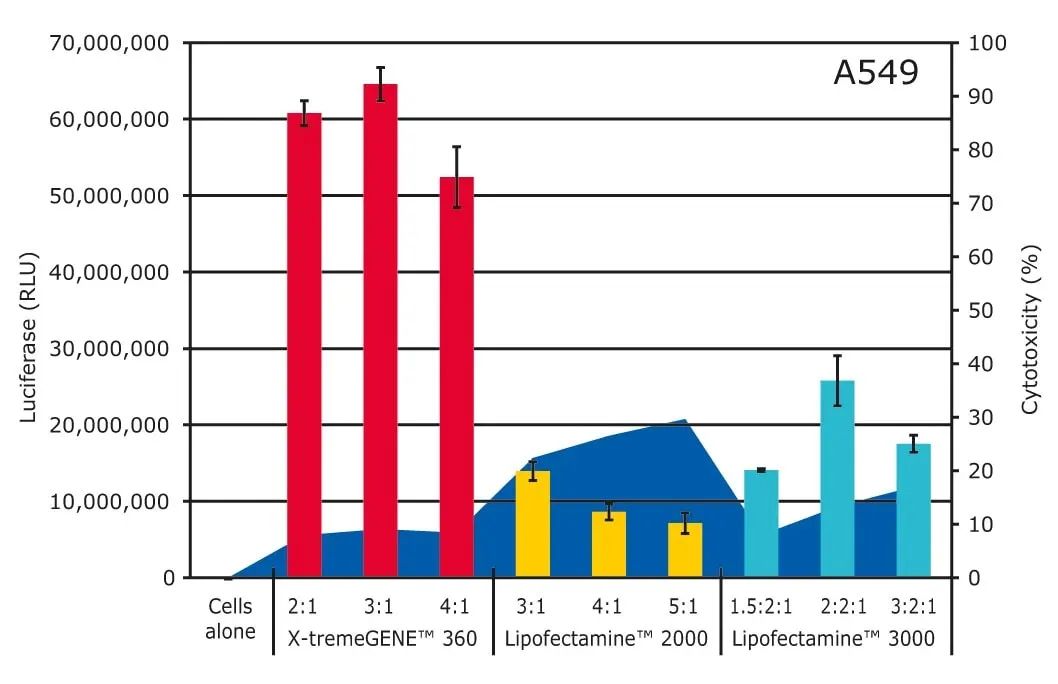
X-tremeGENE™360轉染試劑在轉染效率和(hé)低(dī)細胞毒性方面都勝出了ThermoFisher的Lipofectamine。
相信X-tremeGENE™系列也是大(dà)家(jiā)熟悉的經典轉染試劑,今天Emma女士再來(lái)給大(dà)家(jiā)好好聊聊它。
X-tremeGENE™是Roche公司的注冊商标,我司東銳科技(jì)今年三月份也榮升為(wèi)Roche的一級代理(lǐ)商 。
。
X-tremeGENE™系列是非脂質體(tǐ)轉染試劑,此系列轉染試劑可(kě)以在含血清培養液中進行(xíng)轉染實驗 ,不論是用DNA還(hái)是RNA轉染,也不論是轉染普通(tōng)細胞系或者難轉染的細胞系,都可(kě)以很(hěn)輕松的找到适合的那(nà)一款
,不論是用DNA還(hái)是RNA轉染,也不論是轉染普通(tōng)細胞系或者難轉染的細胞系,都可(kě)以很(hěn)輕松的找到适合的那(nà)一款 。
。
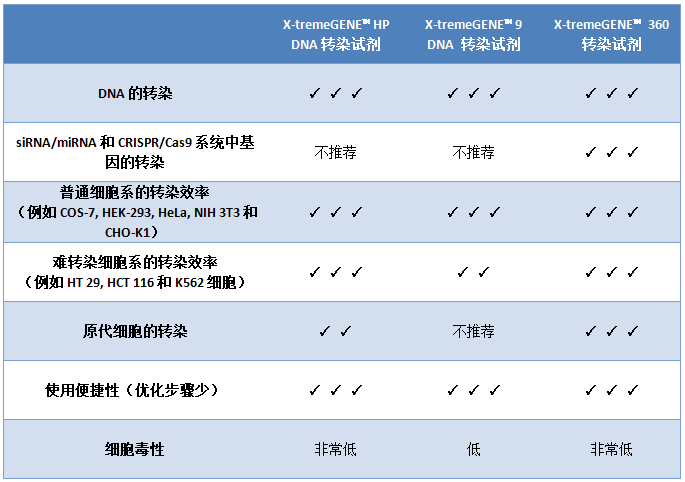
請(qǐng)看更詳細的細胞類型對應表:
用GFP編碼的pcDNA3.1質粒或者熒光素酶編碼的pCI質粒轉染細胞的實驗,驗證了以下細胞類型對應的轉染試劑:
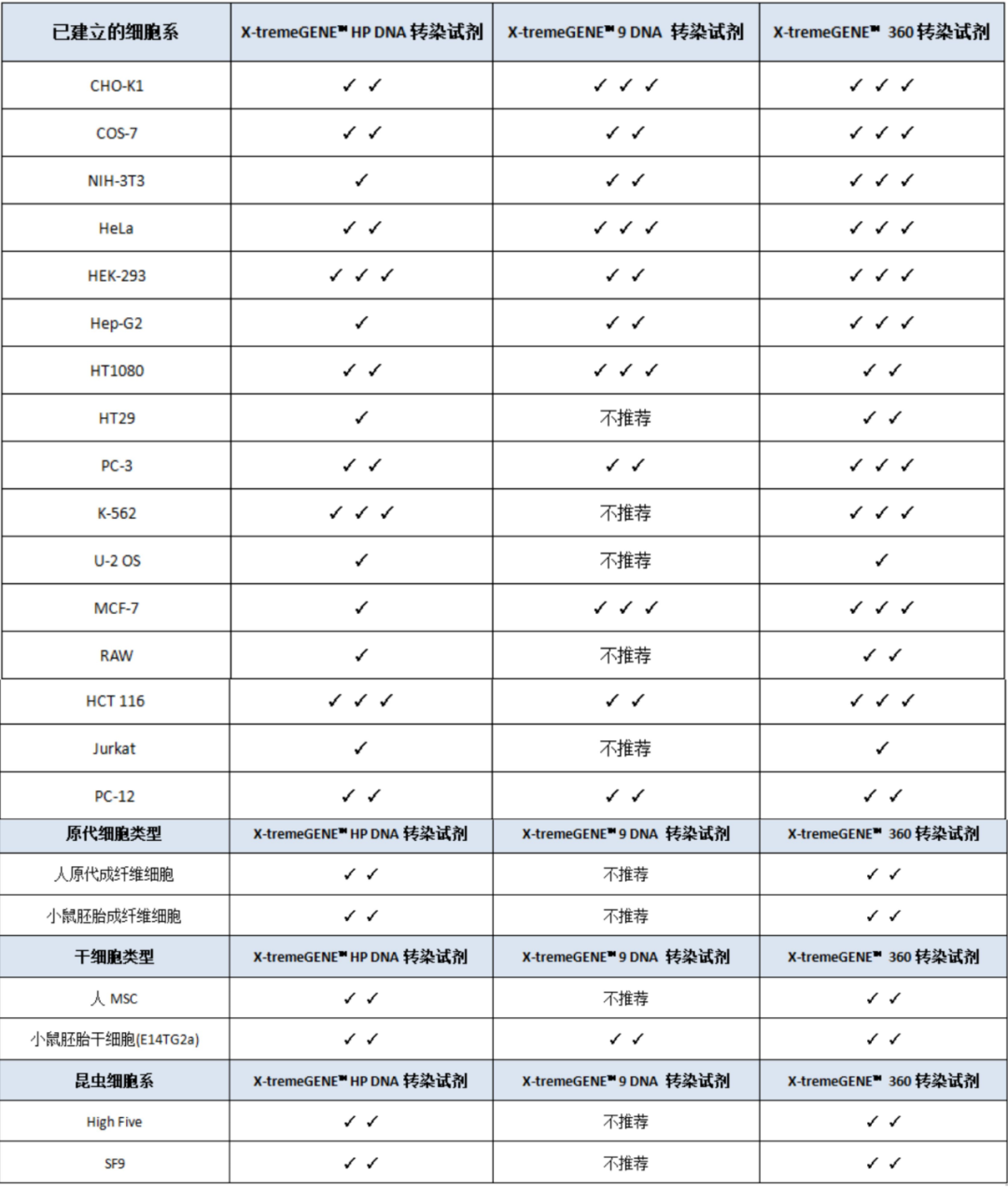
✓:可(kě)以使用;✓✓:推薦使用;✓✓✓:最佳推薦使用
話(huà)不多(duō)說,上(shàng)Protocol幹貨!
X-tremeGENE轉染試劑、DNA和(hé)稀釋液平衡至15~25°C,輕輕Vortex轉染試劑;
用稀釋液稀釋DNA,稀釋液可(kě)以選擇無血清或者減血清培養基,稀釋後的濃度為(wèi)1ug質粒DNA/100ul稀釋液(0.01ug/ul),輕輕混勻;
分别吸取4管100ul(含1ugDNA)稀釋液至四支無菌管中,管上(shàng)分别标記1:1、2:1、 3:1、和(hé)4:1。建議使用無菌離心管或者組織培養處理(lǐ)過的圓底96孔培養闆;
重要貼士:最低(dī)稀釋液的量是100ul,如果低(dī)于100ul會(huì)顯著降低(dī)轉染效率;
分别吸取1、2、3、4ul轉染試劑至剛加入100ul稀釋液(含1ugDNA)的四支無菌管中,對應的标記為(wèi)1:1,2:1, 3:1, and 4:1,注意轉染試劑不要碰觸到塑料管壁,再輕輕混勻;
重要貼士:避免影(yǐng)響轉染效率,未經稀釋的轉染試劑請(qǐng)不要碰觸到塑料管壁,并不要使用矽化處理(lǐ)的吸頭或者吸管。
将轉染試劑和(hé)DNA混合物在15~25°C環境中孵育15分鍾,形成轉染試劑/DNA複合物。
重要貼士:對于某些(xiē)特殊的細胞系或者低(dī)比例的情況可(kě)能需要更長的孵育時(shí)間(jiān),如達到30分鍾。
從培養箱中取出培養容器(qì),培養基可(kě)以不進行(xíng)更換。以一滴滴加入的方式向細胞中加入轉染試劑/DNA的複合物。
重要貼士:對于不同的培養容器(qì),加入複合物的量不同,以12孔闆單孔的量為(wèi)例,每孔中(含1ml細胞培養基)加入100ul轉染試劑/DNA複合物(含1ugDNA);
加入複合物後輕輕混勻培養皿或者培養瓶以保證複合物的均勻分布,如果條件允許,可(kě)以使用搖床低(dī)速混勻30秒(miǎo)。
一旦在細胞中加入了複合物,就無需再像其它轉染試劑一樣需要更換新鮮的培養基。
轉染細胞後将細胞繼續孵育18-72小(xiǎo)時(shí)。孵育的時(shí)間(jiān)受許多(duō)因素的影(yǐng)響,如DNA載體(tǐ)、細胞類型、細胞密度、細胞培養基和(hé)表達蛋白的類型。
孵育之後便可(kě)以選擇合适的方式進行(xíng)蛋白的檢測,如熒光定量或者免疫印迹等。
雖然我們有(yǒu)無比可(kě)靠的轉染試劑,但(dàn)是有(yǒu)時(shí)候為(wèi)什麽還(hái)是會(huì)出現實驗結果不佳的情況呢?
别灰心,這時(shí)候我們需要放大(dà)雙眼,來(lái)看一下Emma女士列出的要點,逐一排除原因,很(hěn)快就可(kě)以做(zuò)出理(lǐ)想的實驗結果,絕對會(huì)給您未來(lái)發表的文章增色哦!
為(wèi)什麽轉染效率不高(gāo)?
影(yǐng)響細胞轉染效率的因素較多(duō),主要包括細胞生(shēng)長狀況、傳代次數(shù)、轉染試劑與質粒的比例和(hé)孵育時(shí)間(jiān)、質粒大(dà)小(xiǎo)等,其中轉染試劑與質粒的比例尤為(wèi)關鍵。
對于不同的細胞類型,轉染試劑與質粒的最佳比例也不同。由于不同細胞表面結構、細胞膜、核膜等結構存在較大(dà)差異,同種轉染試劑在不同細胞的轉染效率也不盡相同。
因此,對于較難轉染的細胞如原代細胞、神經細胞,為(wèi)提高(gāo)轉染效率,必須對轉染試劑與質粒的比例做(zuò)進一步優化。
對于X-tremeGENE™系列的轉染試劑,我們建議轉染試劑與質粒的比例按照1:1、2:1、3:1、4:1(ul:ugDNA)四個(gè)比例進行(xíng)測試,選出最優的比例,對于大(dà)多(duō)數(shù)細胞類型,3:1的比例是最合适的。
對于大(dà)多(duō)數(shù)細胞類型來(lái)說,建議在細胞密度70%-90%之間(jiān)進行(xíng)轉染,過多(duō)或者過少(shǎo)都可(kě)能降低(dī)轉染效率。
轉染後最佳的孵育時(shí)間(jiān)為(wèi)18-72小(xiǎo)時(shí),對于大(dà)多(duō)數(shù)的細胞類型和(hé)質粒來(lái)說,最佳的孵育時(shí)間(jiān)是24-48小(xiǎo)時(shí)。
培養基中一些(xiē)組分如聚陰離子會(huì)影(yǐng)響轉染,保證培養基中無這樣的組分。
稀釋後DNA的量最低(dī)為(wèi)100ul,過低(dī)的量會(huì)顯著降低(dī)轉染效率。
對于大(dà)多(duō)數(shù)細胞類型來(lái)說,建議在細胞密度70%-90%之間(jiān)進行(xíng)轉染,過多(duō)或者過少(shǎo)都可(kě)能降低(dī)轉染效率。
對于常規細胞來(lái)說,無血清培養基的營養成分不夠,會(huì)降低(dī)細胞的存活率,雖然roche的轉染試劑可(kě)以在無血清培養基中進行(xíng)轉染,但(dàn)考慮到細胞需要血清營養成分的供給,應使用正常培養基或者減血清培養基。
應該将複合物以一滴滴緩慢加入的方式加入細胞培養基中,然後輕輕地前後和(hé)左右晃動,使複合物均勻分布。
質粒應該保證是高(gāo)純度無污染的,可(kě)以在提完質粒後或者提的最後一步,用75%乙醇沉澱,這樣可(kě)以起到除菌的效果。
高(gāo)表達的質粒基因産物可(kě)能會(huì)使得(de)細胞本身生(shēng)長緩慢或者存活率下降。
陽離子轉染試劑濃度過高(gāo)時(shí),由于帶有(yǒu)很(hěn)強的正電(diàn)荷,對細胞有(yǒu)一定的毒性,導緻細胞形态發生(shēng)變化,細胞大(dà)量死亡,所以應降低(dī)複合物的濃度或者增加細胞的濃度。
快到文末了,如果您還(hái)沒選擇好您的轉染試劑,也可(kě)以按照下面的表格來(lái)選擇 。
。
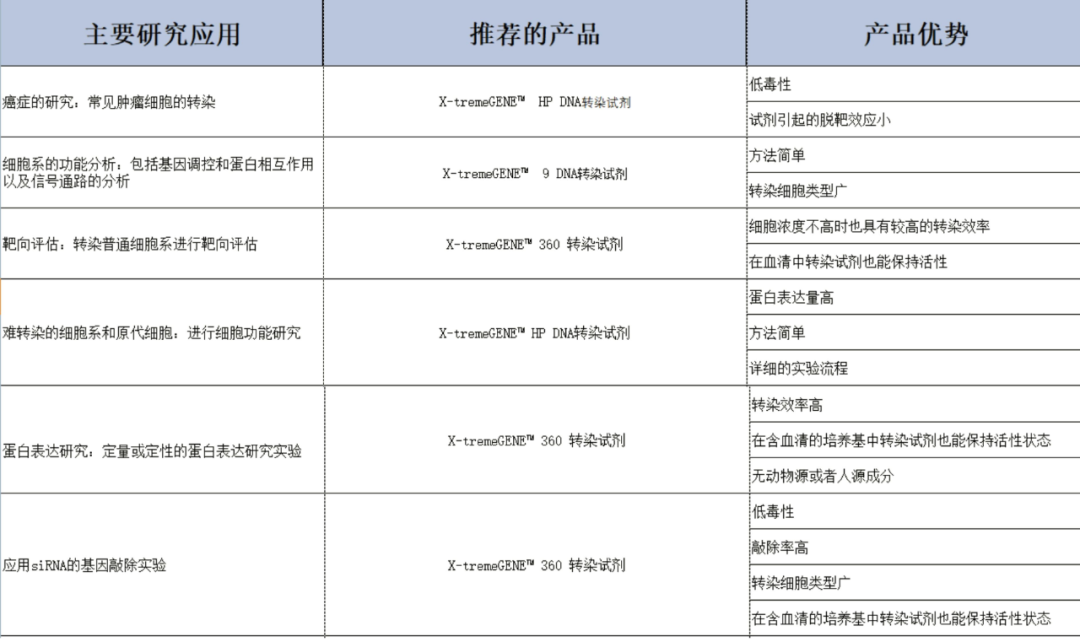
(點擊圖片查看清晰原圖)
如果有(yǒu)更多(duō)的問題,歡迎聯系我們的Emma女士哦,聯系電(diàn)話(huà):13822254356。
— END —